Новости
Лабораторная диагностика клостридиозов сельскохозяйственных животных
17.04.2020
Диагностику клостридиозов проводят комплексно с учетом эпизоотических данных, неблагополучия местности, клинических признаков, характерных патологоанатомических изменений. Лабораторная диагностика складывается из бактериологического исследования биологического материала. Идентификация и дифференциация происходит путем изучения культуральных, морфологических и биохимических особенностей культур. В настоящее время идентификация в значительной мере облегчена использованием диагностических тест-систем и ПЦР-диагностики. Несмотря на то, что клинические и патологоанатомические признаки заболеваний, вызванных клостридиями, часто позволяют точно поставить диагноз, например при столбняке, проведение бактериологических и токсикологических исследований патологического материала является обязательным. Лабораторный диагноз на клостридиозы ставится комплексно на основании ГОСТ 26503-85 «Животные сельскохозяйственные. Методы лабораторной диагностики клостридиозов». Особое значение для подтверждения диагноза имеет постановка биопробы на лабораторных животных, обычно на морских свинках. При этом патологоанатомические изменения у морских свинок бывают столь характерны, что позволяют поставить предварительный диагноз.
Одним из основных условий своевременной и правильной диагностики анаэробных инфекций является четко выполненная процедура отбора и пересылки патологического материала, так как многие возбудители анаэробных болезней быстро гибнут при контакте с воздухом.
Для диагностических исследований при подозрении на клостридиозы в лабораторию направляют свежие трупы телят и ягнят. От крупных животных после вскрытия направляют: кусочки тканей и паренхиматозных органов (печень, почки, селезенка), сердце с перевязанными сосудами; мышцы, взятые на границе здоровой и пораженной ткани; целую трубчатую кость. В случае проведения прижизненной диагностики для исследования отбирают кровь, мочу, мазки и пунктат из пораженных органов, тканей и лимфатических узлов; при поражении органов репродуктивной системы – содержимое матки или истечения из влагалища. Отбор проб патологического и/или клинического материала, его упаковка и транспортировка осуществляется ветеринарными врачами предприятия или органов государственного контроля. Каждую пробу материала отдельно помещают в стерильные одноразовые контейнеры или стеклянную посуду, не допуская загрязнения их наружной поверхности.
Транспортировать пробы необходимо в переносках с раздельными гнездами и возможностью соблюдения температурного режима. Отбор проб материала необходимо проводить до применения антибактериальных препаратов, при отсутствии такой возможности - непосредственно перед повторным введением. Учитывая высокую чувствительность большинства видов клостридий к кислороду, пробы материала отправляют в лабораторию немедленно после получения с целью сохранения жизнеспособности возбудителей и предотвращения избыточного роста сопутствующей микрофлоры. Пробы транспортируют и хранят до начала исследования в холодильнике при температуре 2-8 °С. В случае использования для транспортирования в лабораторию проб материала в пробирках с транспортировочной средой, обеспечивающей жизнеспособность бактерий в течение 72 ч, допускается их хранение на среде Эймса при температуре 18-20 °С. В случае невозможности отправки материала в лабораторию сразу после взятия, допускается его однократное замораживание, транспортирование и хранение при температуре минус 18 0С и ниже.
Для пересылки жидкого материала (тканевой экссудат, содержимое очагов поражения, кровь, моча) можно использовать шприцы. После наполнения шприца из него удаляют остатки воздуха, закрыв иглу стерильным ватным тампоном. Иглу дезинфицируют 70% этиловым спиртом. Для герметизации конец иглы вкалывают в стерильную резиновую пробку и в таком виде шприц с материалом доставляют в лабораторию. При сборе большого объема материала (3 мл и более) анаэробные бактерии могут оставаться жизнеспособными в течение 24 ч при комнатной температуре (18-20 °С). Содержимое желудка и кишечника направляют в лабораторию после консервирования хлороформом (одна капля на 10 см3 патологического материала), а также стерильным 30-40 % раствором глицерина в соотношении 1:1. В случае быстрой доставки в лабораторию, допускается пересылать не консервированный материал. Отобранные пробы должны быть доставлены в лабораторию не позднее 4 часов с момента гибели животного, а консервированные - в течение 2 суток.
При необходимости установления источника заражения возможно направление на исследование объектов окружающей среды (почва, трава, фураж, подстилка, вода, смывы и т.д.).
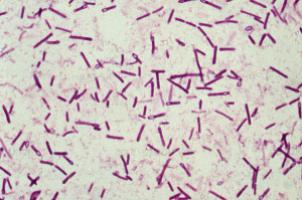
Учет, хранение, передача, транспортирование и утилизация материала, предназначенного для исследования на Clostridium spp., должны осуществляться в соответствии с действующими санитарными правилами и нормами. Исследование материала включает выделение и идентификацию возбудителя или его токсина в исследуемом материале. Одним из критериев предварительной диагностики клостридиозов животных является обнаружение возбудителя в мазках, приготовленных из проб патологического материала. Мазки из крови, мочи и экссудата делают путем нанесения капли материала на стекло с последующим равномерным распределением по его поверхности. Для микроскопии мазков из органов и тканей готовят мазки отпечатки. Для этого кусочек образца ткани, взятый по возможности из глубины исследуемого материала, разрезают пополам и свежим срезом несколько раз прислоняют к поверхности предметного стекла. Целесообразно готовить мазки отпечатки используя вторую часть образца материала, оставшуюся при посеве отпечатками на агаризированные среды. Мазки подсушивают, фиксируют в спиртовой смеси или над пламенем горелки и окрашивают по Граму. Присутствие грамположительных палочек и спор позволяет предположить наличие возбудителей клостридиозов. Материал, переданный на исследование в пробирках с транспортировочными средами, для приготовления мазков не используют в связи с высоким риском контаминации посторонней микрофлорой, либо мазки готовят после посева материала на питательные среды.
Материал подготовлен специалистами Лаборатории по диагностике АЧС (африканской чумы свиней) и других особо опасных заболеваний животных ФГБУ «Ростовский референтный центр Россельхознадзора».